اوراق عمل كيمياء الغازات للصف العاشر المتقدم
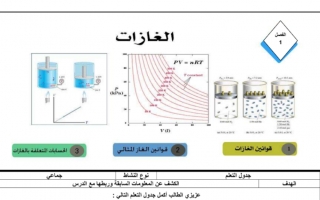
قوانين الغازات
*تغير أحد المتغيرات في القانون يؤدي لتغير المتغيران الآخران
1 قانون بويل
……………………………………………………………………
P1 V1 = P2 V2
P1 = ضغط الغاز الأول V1 = حجم الغاز الأول P2 = ضغط الغاز الثاني V2 = حجم الغاز الثاني
تدريب 1 : اذا كان حجم غاز عند ضغط 0Kpa.99 هو ml 300 وأصبح الضغط kpa 188 احسب الحجم الجديد؟
…………………………………………………………………………………………………
تدريب 2 اذا كان ضغط عينة من الهيليوم في اناء حجمه 1.00 هو atm 0.988 فما ممدار ضغط هذه العينة اذا نقلت الى وعاء حجمه L 00.2
……………………………………………………………………………………………………….
تدريب 3 : اذا كان مقدار حجم غاز محصور تحت مكبس اسطوانة L 145 وضغطه atm1.08 فما حجمه الجديد عندما يزداد الضغط بمقدار %25
…………………………………………………………………………………………………….
2 قانون شارل
……………………………………………………………………………………………………..
V1/T1 V2/T2
V1 = حجم الغاز الأول
T1 = درجة الحرارة المطلقة ( كلفن )للغاز الأول ( °C + 273 = T)
V2 = حجم الغاز الثاني
T2 = درجة الحرارة المطلقة ( كلفن )للغاز الأول ( °C + 273 = T)
تدريب 1 شغل غاز عند درجة حرارة °C 89 حجما مقداره L 0.76 عند اي درجة حرارة سيليزية سيزيد الحجم ليصل الى 1.12؟
…………………………………………………………………………………………………………..
تدريب 2 ما حجم الهواء في بالون يشغل حيزا مقداره L 0.062 اذا انخفضت درجة الحرارة من °C 25 الى °C 0.0
…………………………………………………………………………………………………………
تدريب3 : اذا انخفضت درجة الحرارة السيليزية لعينة من غاز حجمها L 0.3 من °C 0.80 الى °C 0.30 فما الحجم الجديد للغاز
………………………………………………………………………………………………………..
3 قانون جاي لو سان
……………………………………………………………………..
P1/T1 P2/T2
P1 = ضغط الغاز الأول
T1 = درجة الحرارة المطلقة ( كلفن ) للغاز الأول ( °C + 273 = T)
P2 = ضغط الغاز الثاني
T2 = درجة الحرارة المطلقة ( كلفن ) للغاز الأول ( °C + 273 = T)
تدريب 1 :اذا كان ضغط اطار سيارة atm 1.88 عند حرارة °C 250 فكم يكون الضغط اذا ارتفعت درجة الحرارة الى °C 37
…………………………………………………………………………………………………..
تدريب 2 : وجد غاز الهيليوم في اسطوانة حجمها L 2 تحت تؤثير ضغط جوي ممداره 1.12فإذا اصبح ضغط الغاز atm 2.56 عند درجة حرارة °5C.36 فما قيمة درجة حرارة الغاز الابتدائية؟
…………………………………………………………………………………………………..
تدريب 3: وجد أن ضغط غاز محصور في اسطوانة مغلقة يساوي Kpa 125 عند درجة حرارة °C 0.30 كم تصبح درجة حرارته اذا زاد الضغط في الأسطوانة ليصل Kpa 201
………………………………………………………………………………………………….
4 القانون العام للغازات
P1 V1/T1
P2 V2/T2
تدريب 1 : يحتوي بالون على 146 من الغاز المحصور تحت ضغط مقداره 1.30 ودرجة حرارية 5 فإذا تضاعف الضغط وانخفضت درجة حرارة إلى 2 فكم يكون حجم الغاز في البالون ؟
…………………………………………………………………………………………………….
تدريب 2 : عبوة مشروب غازي مرنة مغلقة وباردة حجمها L 2 تحتوي ml 46 من الغاز تحت ضغط atm 30.1
ودرجة حرارة °C 5 فإذا سقطت العبوة في بحيرة وغمرت حتى عمق كان الضغط عنده atm 1.52 وكانت
درجة الحرارة °C2.09 فكم يصبح حجم الغاز في العبوة
…………………………………………………………………………………………………..
قانون الغاز المثالي
يعرف مبدأ أفوجادرو على أن: ……………………………………………………………………………….
…………………………………………………………………………………………………………………
قانون الغاز المثالي
P V = n R T
P = الضغط
V = حجم الغاز
N = عدد المولات
R = الثابت العام للغازات = 0821.0
T = درجة الحرارة المطلمة ( كلفن °C + 273 = K)
M / m = n عدد المولات = الكتلة بالجرام / الكتلة المولية
تدريب 1 : ما حجم الوعاء اللازم لاحتواء 0.0459 من غاز النيتروجين في الظروف المعيارية STP
……………………………………………………………………………………………………..
تدريب 2 : ما كتلة غاز ثاني أكسيد الكربون CO2 بالجرامات الموجودة في بالون حجمه 1.0في الظروف المعيارية ؟
…………………………………………………………………………………………………….
تدريب 3: ما درجة حرارة mol 2.49 من غاز موجود في اناء سعته L 0.1 وتحت ضغط مقداره 143Kpa
……………………………………………………………………………………………….
تدريب 4: احسب حجم mol 0.323 من غاز عند درجة حرارة K 256 وضغط جوي مقداره atm 0.90
……………………………………………………………………………………………..
قانون الغاز المثالي واشتقاق الكتلة والكثافة
1. P V = n R T 2. n = m / M 3. D = m / V
قانون الغاز المثالي ( الضغط × الحجم = الموالت × ثابت الغازات × درجة الحرارة المطلقة )
قانون المولات ( المول = الكتلة بالجرام ÷ الكتلة المولية )
قانون الكثافة ( الكثافة = الكتلة ÷ الحجم )
من ) 1 ) و ) 2 ) نجد أن
وحيث أن V / m = D فان
M= ( m R T ) / P V
(D = ( M P ) / ( R T
تدريب 1 : ما كثافة غاز الكلور Cl2 عند 22 وضغط 2 (Cl = 35.5 )
………………………………………………………………………………………………….
تدريب 2: أوجد ضغط غاز النيتروجين N2 الذي كثافته 2.05 عند درجة حرارة 12.5 (N=14 )
………………………………………………………………………………………………
قارن بين الغاز المثالي والغاز الحميمي
الغاز الحقيقي
الغاز الحميمي
الحسابات المتعلقة بالغازات
لديك التفاعل التالي : 2AB B + A 2 ماذا تستنتج من هذه المعادلة الكيميائية الموزونة
جـ : نستنتج أن mol 2 من المادة A تفاعل مع 1mol من المادة B فأنتج 2mol من لمادة AB
وطبقا لمبدأ افوجادرو بإمكاننا أن نقول:
أن L 2 من المادة A تفاعل مع 1L من المادة B فأنتج 2L من المادة AB
هناك شرطين لكي تستطيع حساب الحجم
1 .أن يكون هناك معادلة كيميائية موزونة
2 .وحجم معلوم لأحد الغازات المشاركة في التفاعل
تدريب 1: ما حجم الهيدروجين الازم للتفاعل مع من غاز الأكسجين لإنتاج الماء ؟
……………………………………………………………………………………………….
حساب الحجم والكتلة
خطوات حساب الكتلة للمادة المطلوبة
1ٌ .ستخدم نفس الطريقة السابقة لحساب الحجم للمادة المطلوبة
2 .حساب عدد المولات من لانون الغاز المثالي ( T R ) / ( V P = ( n
3 .حساب كتلة المادة من القانون التالي M x mol = m ( الكتلة = الكتلة الموليه × عدد المولات)
تدريب 1 : تحضر الأمونيا من غاز الهيدروجين وغاز النيتروجين وفما للمعادلة التالية : 2NH3 3H2 + N2 اذا تفاعل L 0.5 من غاز النيتروجين مع غاز الهيدروجين عند ضغط atm 0.3 ودرجة حرارة K 298 فما كمية الأمونيا الناتجة
……………………………………………………………………………………………………..
تدريب 2 : عندما يصدأ الحديد يكون لد تفاعل مع الأكسجين ليكون أكسيد الحديد (II ) كم لترا من غاز الأكسجين عند STP الازم ليتفاعل مع 0g.52 من الحديد : 2Fe2O3 يعطي 3O2 + 4Fe
……………………………………………………………………………………………………