أسئلة إثرائية هيكل امتحان الكيمياء الصف الثاني عشر متقدم الفصل الثالث
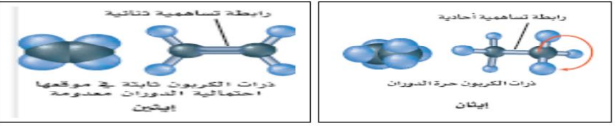
_ نماذج جزيء الميثان
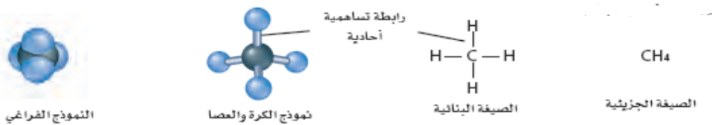
_ الصيغة الجزئية : توضح نوع الذرات في الجزيء ( لا تعطي معلومات حول هندسة الجزيء )
_ الصيغة البنائية : تظهر الترتيب العام للذرات في الجزيء ( لا تظهر الشكل ثلاثي الأبعاد بدقة )
_ نموذج الكرة و العصا : يظهر هندسة الجزيء بشكل واضح
_ نموذج ملء الفراغ : يعطي صورة اكثر واقعية عن الكيفية التي يبدو فيها الجزيء
_ ترتبط ذرات الكربون مع بعضها بروابط أحادية أو ثنائية أو ثلاثية و يمكن توضيح ذلك بأشكال لويس
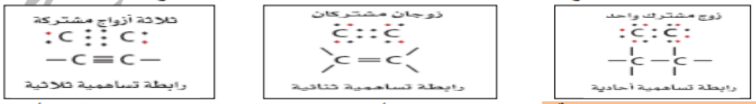
_ الهيدروكربونات المشبعة : تحتوي على روابط أحادية فقط ، و لا تتفاعل مع اليروم ، مثال : الألكانات
_ الهيدروكربونات غير المشبعة : تحتوي على رابطة ثنائية أو ثلاثية واحدة على الأقل ، و تتفاعل مع البروم ، مثال : الألكينات و الأكاينات
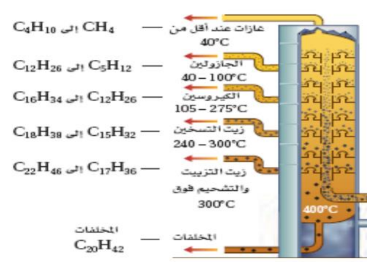
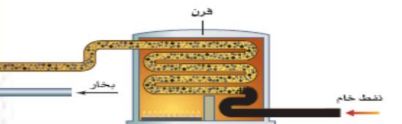
- يفصل النفط الخام ( الزيت الخام ) ( خليط معقد من أكثر من ألف هيدرووكربون ) إلى مكونات أبسط من خلال عملية التقطير التجزيئي
_ التقطير التجزيئي ( التجزئة ) : عملية تتضمن تبخير النفط عند درجة الغليان ثم تجمع المكونات المختلفة أثناء تكثفها عند درجات حرارة متباينة
- تجرى عملية التقطير التجزيئي في أبراج للتجزئة يتم التحكم في درجة الحرارة داخلها ، فتكون درجة الحرارة أسفل البرج قريبة من 400 C و تنخفض تدريجيا أعلاه
- تنخفض درجات حرارة تكثف المواد مع انخفاض الكتلة الجزيئية لها
- بزيادة عدد ذرات الكربون في الجزيء تزداد اللزوجة
| الألكانات | مشبع |  | ترقيم + الألكيل + عدد ذرات الكربون ( أطول سلسلة ) + ان |
| الألكانات الحلقية | مشبع | 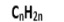 | ترقيم + الألكيل + عدد ذرات الكربون + ان + حلقي |
تسمية الألكانات ذات السلاسل المتفرعة

_ تطبيقات :
8 -
أ - 2,4 - ثنائي ميثيل الهكسان
ب - 2,4 ، 2 - ثلاثي ميثيل بنتان
ج - 4,7 ، 2 - ثلاثي ميثيل نوتان
أ - استخدم قواعد IUPAC لتسمية الصيغ البنائية الآتية
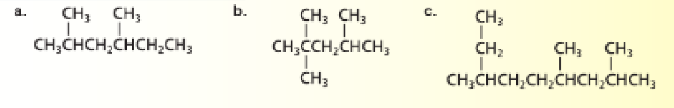
ب - تحدي ارسم الصيغ البنائية الصيغ البنائية للألكانات التالية
1 - 3,2 ثنائي ميثيل 5 – بروبيل ديكان
2 - 5,4,3 ثلاثي إيثيل أوكنان
مثال 2 : ( 1 ، 2 ، 4 - ثلاثي ميثيل هكسان حلقي )
تسمية الألكانات الحلقية
- قم بتسمية الألكان الحلقي المجاور
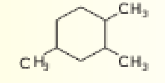
_ نطبيقات
10 - استخدم قواعد IUPAC لتسمية الصيغ البنائية الآتية
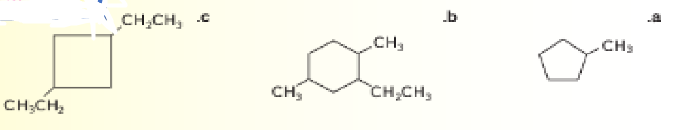
11 - تدريب تحفيزي ارسم الصيغ البنائية للألكانات الحلقية الآتية
أ - 1 - إيثيل - 3 - بروبيل بئتان حلقي
ب - 1 ، 2 ، 2 ، 4 - رباعي ميثيل هكسان حلقي
_ خصائص الألكانات
- الصيغة البنائية للجزيء تؤثر في خصائصه
- جزيئات الألكانات غير قطبية لأن روابطها جميعا غير قطبية ( الاختلاف بسيط في السالبية الكهربائية )
مما يجعلها مذيبات جيدة للمواد غير قطبية
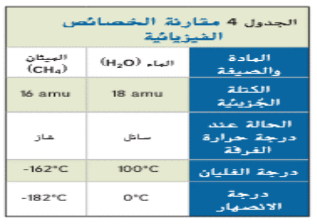
- الخصائص الفيزيائية :
_ الكتلة الجزيئية للميثان amu 16 قريبة من الكتلة الجزيئية للماء amu 18 و كذلك يتقاربان في الحجم
_ تقل درجة غليان و انصهار الميثان عن الماء لضعف قوى التجاذب بين جزيئات الميثان ( جزيئات غير قطبية لا تكون روابط هيدروجينية و ليس لديها شحنة )
_ بسبب القطبية و الروابط الهيدروجينية لا تمتزج الألكانات و الهيدروكربونات الأخرى بالماء ( لضعف قوى التجاذب بين الألكان و الماء )
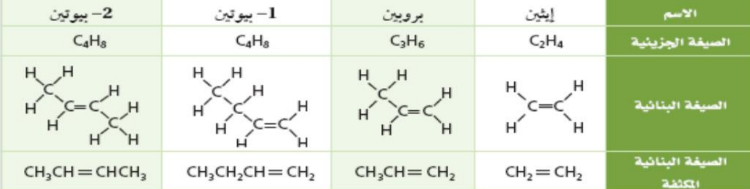
| الألكينات | = (غير مشبع) |  | ترقيم + الألكيل + رقم الرابطة الثنائية + عدد ذرات الكربون + بن |
مثال 3 :
_ تسمية الألكينات ذات السلاسل المتفرعة
قم بتسمية الألكين ذو الصيغة البنائية الآتية
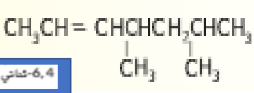
_ تطبيقات :
17 - استخدم قواعد IUPAC لتسمية الصيغ البنائية الآتية .

18 - تحدي ارسم الصيغة البنائية للمركب 3,1 - بتتادايين
| الألكينات | = (غير مشبع) |  | ترقيم + الألكيل + رقم الرابطة الثنائية + عدد ذرات الكربون + بن |
الجدول 6 أمثلة على الألكاينات
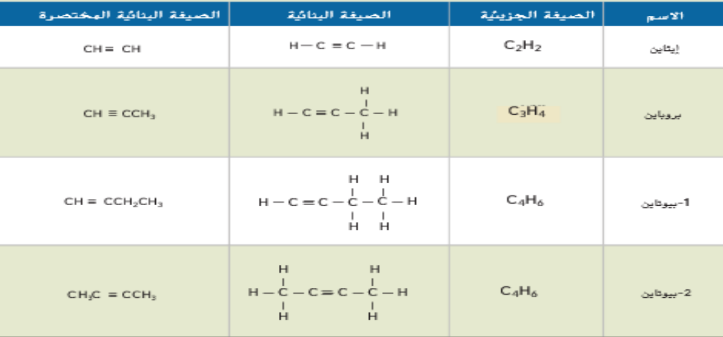
21 - قم بتسمية البنى المبينة مستخدما قواعد IUPAC
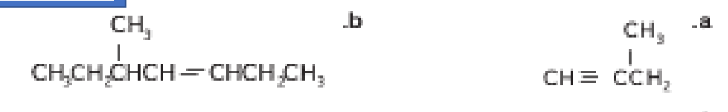
22 - أرسم الصيغة البنائية لكل من 4 - ميثيل - 3,1 - بيتنادين و 3,2 - ثنائي ميثيل - 2 - بيوتين
_ الإيزومرات : اثنان أو أكثر من المركبات لها الصيغة الجزيئية نفسها إلا أنها تختلف في صيغتها البنائية
- الأيزومرات البنائية
- لها نفس الصيغة الكيميائية إلا أن ترتيب الذرات فيها تختلف (تختلف الخصائص الفيزيائية و الكيميائية)
_ مثال : الصيغة الجزئية
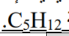
| المركب | البنتان | 2 - ميثيل بيوتان | 2,2 - ثنائي ميثيل بروبان |
| درجة الغليان | 36,1 C | C 27,9 | 9,45 C |
- كلما زاد عدد ذرات الكربون في الهيدروكربون زاد عدد الأيزومرات المحتملة
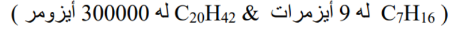
_ الأيزومرات الفراغية
- ترتبط فيها الذرات بالترتيب نفسه و لكنها تختلف في ترتيبها الفراغي ( الاتجاهات في الفراغ )
- لها نوعان في الألكينات و الالكانات ، لكن الألكانات بها رابطة أحادية بين ذرات الكربون تساعدها على الدوران بسهولة ، بعكس الألكينات التي تحتوي على رابطة ثنائية لا تسمح للذرات بالدوران و تجعلها ثابتة
_ الأيزومرات الهندسية
- أيزومرات ناتجة عن اختلاف ترتيب المجموعات و اتجاهها حول الرابطة الثنائية
- يؤثر الترتيب الهندسي في الخواص الفيزيائية ( درجات الانصهار و الغليان )
- لأيزومرات سيس (مع) ( cis ) و ترانس (ضد) ( trans ) عادة تأثيرات مختلفة و واضحة جدا
| المركب | ترانس - 2 - بيوتين | سيس - 2 - بيوتين |
| الصيغة البنائية | 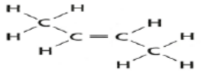 | 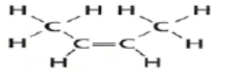 |
| درجة الانصهار | 106C - | 139C - |
| درجة الغليان | 0.8C | 3,7C |
- التركيب الذي تكون فيه مجموعتا الميثيل في نفس الجهة من الجزيء يشار إليه بالبادنة ( سيس )
- التركيب الذي تكون فيه مجموعتا الميثيل في جهتين متقابلتين يشار إليه بالبادنة ( ترانس )
- كيكوليه اقتراح التركيب للبنزين ( شكل سداسي يتكون من 6 ذرات كربون تتناوب من الروابط الأحادية و الثنائية)
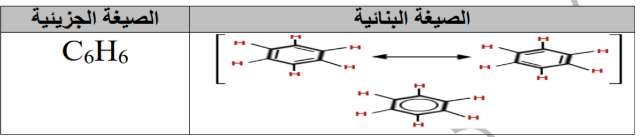
- البنزين مستقر كيميائي (خامل) بسبب الالكترونات غير المتموضعة ( أقل نشاطاً من الألكينات )
_ المركبات الأروماتية : مركبات عضوية تحتوي على حلقة من البنزين كجزء من تركيبها
_ المركبات الأورماتية ذات روائح عطرية جذابة
_ المركبات الأليفاتية : الألكانات و الالكينات و الألكاينات
_ كلمة أليفاتي ( تعني دهن ) ، حصل الكيميائيون على مركب أليفاتي من تسخين الدهون الحيوانية
| الهيدروكربونات الأروماتية | تحتوي على حلقة بنزين | ترقيم + الألكيل + بنزين |
3,1 - ثنائي بروبيل بنزين :
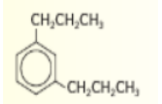
_ تطبيقات :
31 - حدد اسم المركبات التالية
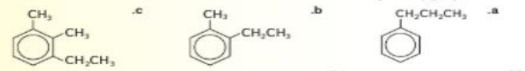
32 - التحدي ارسم الصيغة البنائية 4,1 - ثنائي ميثيل بنزين
| هاليد الألكيل | X - | 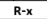 | ترقيم + الهالوجين + و + الألكان (حلقي) |
| هاليد الأريل | X - | 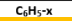 | ترقيم + الهالوجين + و + بنزين |
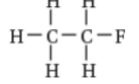 فلورو إيثان | 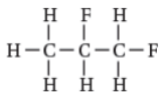 1, 2 - ثنائي فلورو بروبان | 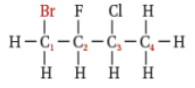 1 - برومو - 3 - كلورو - 2 - فلورو بيوتان | 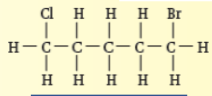 1 - برومو - 5 - كلورو بنتان |
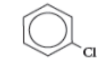 كلورو بنزين |
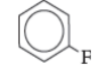 فلورو بنزين | 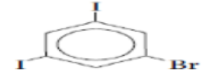 1 - برومو - 3, 5 - ثنائي أيودو بنزين | 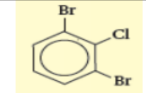 1, 3 ثنائي برومو - 2 - كلورو بنزين |
_ خواص هاليدات الالكيل و استعمالاتها
1 - اعلى درجة غليان و كثافة من الالكان الذي له ذرات الكربون نفسها
2 - تزداد درجة الغليان و الكثافة عند الانتقال من F الى CL و Br و I لزيادة عدد الالكترونات البعدية عن النواة في الهالوجين
3 - تكون هاليدات الالكيل اقطاب مؤقتة لان الالكترونات البعيدة عن النواة تغير اماكنها بسهولة و تزداد درجة الغليان لتجاذب الاقطاب معا فتحتاج طاقة عالية لفصلها عن بعضها ( تزداد درجة الغليان بزيادة الحجم الذري للهالوجين )
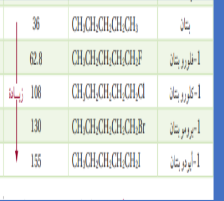
_ تفاعلات الإستبدال
| الهلجنة | هاليد هيدروجين | + | هاليد الكيل | < - - - - | هالوجين | + | الكان | 1 |
| هاليد | + | كحول | < - - - - | هيدروكسيد | + | هاليد ألكيل | 2 | |
| هاليد هيدروجين | + | أمين | < - - - - | أمونيا | + | هاليد ألكيلل | 3 |
_ مثال على التفاعلات الاستبدال (الهلجنة)

_ مثال على التفاعلات تكوين الكحولات

_ مثال على التفاعلات تكوين الأمنيات
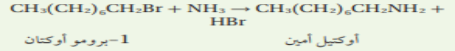
- زاوية الرابطة التساهمية من الأكسجين في اللإيثانول تساوي تقريبا زاوية الرابطة التساهمية من الأكسجين في الماء ، لذا تكون مجموعة OH - في جزيئات الكحول متوسطة القطبية كما في جزيئات الماء
- درجة غليان الكحول أعلى من درجة غليان الهيدروكربون المماثل لان مجموعة الهيدروكسيل تكون روابط هيدروجينية مع مجموعات هيدروكسيل في جزيئات كحول أخرى
- بسبب القطبية و الروابط الهيدروجينة يمتزج الإيثانول تماما بالماء ( يفصلان عن عملية التقطير لكن يتبقى بعد الفصل % 5 في صورة مزيج )
- بسبب قطبية OH تعتبر الكحولات مذيبات جيدة للمركبات العضوية القطبية الأخرى
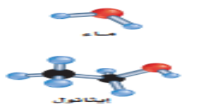
- لا تكون الإيثرات روابط هيدروجينة لعدم وجود ذرات هيدروجين مرتبطة مع ذرة الأكسجين في الإيثر
- أكثر قابلية للتطاير و درجة الغليان و الذائبية في الماء اقل من الكحولات المقابلة لعدم وجود روابط هيدروجينية بين جزيئاتها
- يمكن لذرة (O) في الإيثر أن تستقبل ذرات H من جزيئات الماء ( تذوب في الماء )

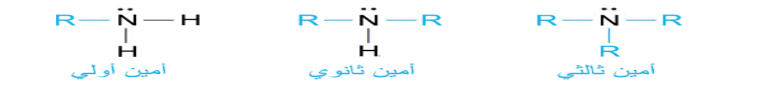
_ الأمينات : المركبات العضوي التي تحتوي على ذرة نيتروجين واحدة أو أكثر مرتبطة مع ذرات كربون في سلاسل اليفاتية أو حلقات أروماتية
_ الصيغة العامة :
- الأمنيات مشتقة من الأمونيا NH3
- تصنف الأمنيات إلى أولية و ثانوية و ثالثية حسب عدد ذرات الهيدروجين في الأمونيا
_ الالدهيد : مركب يتكون من سلسلة من ذرات الكربون يوجد ي نهايتها مجموعة كربونيل متصلة من طرف بذرة كربون و من الطرف الاخر بذرة هيدروجين
_ الصيغة العامة : CHO * [ تمثل مجموعة R او ذرة H )
_ التسمية : اسم الالكان + ال
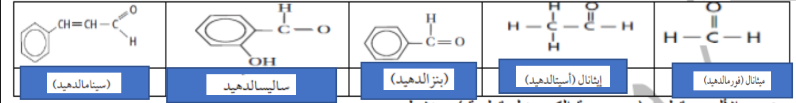
_ جزيء الالدهيد قطبي ( مجموعة الكربونيل قطبية ) و نشط
_ لا يمكن لجزيئات الالدهيد ان تشكل روابط هيدروجينية بين يعضها البعض لعدم احتوائها على ذرة H مرتبطة مع ذرة O لذا درجة غليان الالدهيدات اقل من درجة غليان الكحولات التي لها نفس عدد ذرات الكربون
_ الالدهيدات اكثر قابلية للذوبان في الماء من الالكانات لانها يمكن ان تشكل روابط هيدروجينية مع ذرات O في جزيئات الماء ( ليس بنفس درجة الكحولات و الامينات )
_ الكيتون : مركب عضوي ترتبط ذرة الكربون الموجودة في مجموعة الكربونيل مع ذرتي كربون اخرتين
_ الصيغة العامة : R - CO - R
_ التسمية : الترقيم + اسم الالكان + ون أو مجموعة الالكيل + كيتون
| الكيتون | CO | RCOR | الترقيم + اسم الالكان + ون أو مجموعة الالكيل + كيتون |

_ تشترك الكيتونات و الالدهيدات في العديد من الخصائص الفيزيائية و الكيميائية بسبب تشابه بنيتها
_ الكيتونات قطبية و لكنها اقل نشاطاً من الالدهيدات, و هي مذيبات جيدة للمركيات العضوية متوسطة القطبية ( الشموع / البلاستيك / الدهان / الطلاء / الورنيش / الغراء )
_ لا يمكن لجزيئات الكيتون ان تشكل روابط هيدروجينية مع بعضها و هي تشكل روابط هيدروجينية مع جزيئات الماء
_ الكيتونات قابلة للذوبان في الماء نسبياً ( الاسيتون يذوب في الماء )
_ الاحماض الكربوكسيلية :
_ حمض المثانويك ( جمض الفورميك ) ( مادة سامة ) تنتجه بعض الحشرات اللاسعة كوسيلة دفاعية
_ الاحماض الكربوكسيلية قطبية و نشطة, و تتأين في الماء بشكل ضعيف منتجة الهيدرونيوم و ايونات الحمض

_ تتأين الاحماض الكربوكسيلية في الماء لان ذرتي O ذات سالبية كهربية عالية و تجذب الالكترونات بعيداً عن ذرة H في ( HO ) و لذلك ينتقل H الى ذرة اخرى يكون لديها زوج الكترونات غير مرتبطة مثل ذرة O في جزيء الماء .
_ محاليل الاحماض الكربوكسيلية مثل حمض الاوكساليك و حمض الاديبيك على مجموعتي او اكثر من الكربوكسيل ( احماض ثنائية الكربوكسيل )
_ حمض اللاكتيك ( يوجد في اللبن ) يحتوي مجموعة هيدروكسيل إضافة الى مجموعة الكربوكسيل , لذا تكون قابليته للوبان في الماء اكثر من الاحماض التي تحتوي على مجموعة كربوكسيل واحدة .
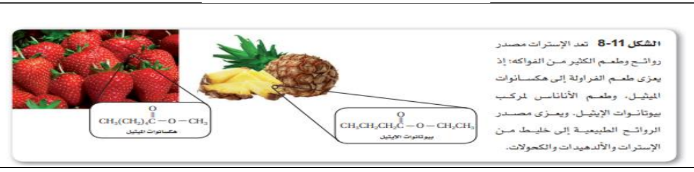
_ الاستر :
| الاستر | COO | RCOOR | الالكان ( المرتبط COO ) + وات + الالكيل |

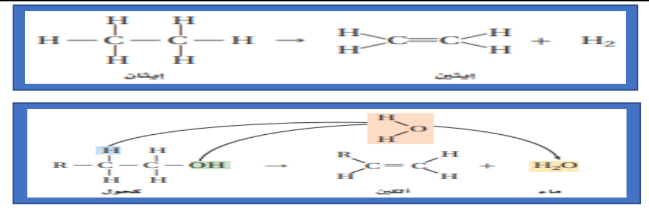
_ تفاعلات الحذف ( النزع )
_ اولاً : الحذف من ذرتي كربون متجاورتين في مركب واحد
| هيدروجين | + | الكين | <<<< | الكان | 1 |
| الماء | + | الكين | <<<< | كحول | 2 |
| هاليد هيدروجين | + | الكين | <<<< | هاليد ألكيل | 3 |
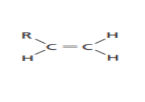
_ تفاعلات الاضافة
| الهدرجة | الكان | <<<< | هيدروجين | + | الكين | 1 |
| كحول | <<<< | الماء | + | الكين | 2 | |
| هاليد ألكيل | <<<< | هاليد هيدروجين | + | الكين | 3 | |
| ثنائي هاليد الكيل | <<<< | هالوجين | + | الكين | 4 |
_ الجدول 12 - 8
| الألكين المتفاعل | المادة المتفاعلة المضافة | المادة الناتجة |
 | الماء 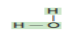 | الكحول 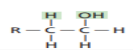 |
الهيدروجين 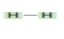 | ألكان  | |
هاليد الهدروجين 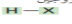 | هاليد الألكيل 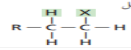 | |
الهالوجين  | ثنائي هاليد الألكيل  |