حل درس التفاعلات الكيميائية أحياء تاسع متقدم
نقدم لكم حل درس التفاعلات الكيميائية الصف التاسع متقدم للفصل الدراسى الأول، يتضمن الملف حل الأنشطة والتقويم للدرس (التفاعلات الكيميائية) فى مادة الأحياء للصف التاسع متقدم الفصل الأول
حل درس التفاعلات الكيميائية للصف التاسع متقدم: بإمكانكم تحميل هذا الملف على شكل بي دي إف PDF جاهز للتشغيل على أي جهاز لوحي أو إلكتروني أو كمبيوتر عن طريق زر التحميل فى الأعلى، كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة.
التفاعلات الكيميائية
تمهيد
ما العلاقة بين الرابطة الكيميائية و التفاعل الكيميائي؟
تتكون الروابط الكيميائية و تتكسر بسبب التفاعلات الكيميائية
المتفاعلات و النواتج
تكون السبارة الجديدة المطلية بالكروم اللامع و ذات المظهر النظيف جذابة للعديد من السائقين لكن مع مرور الوقت قد تصدأ هذه السيارة وتفقد بريقها و الصدأ هو نتيجة تغير كيميائي يُسمى تفاعلاً كيميائياً و التفاعل الكيميائي هو عملية نتخذ خلالها الذرات أو مجموعات الذرات الموجودة فى المواد ترتيباً جديداً يتسيب في تحوّل هذه المواد إلى مواد مختلفة. تتكسّر الروابط الكيميائية و تتكوّن خلال التفاعلات الكيميائية فالصدأ الذي يغطي السلسلة هو مركب يُسمى أكسيد الحديد تكوّن عندما تفاعل الأكسجين (O2) الموجود فى الهواء مع الحديد
من المهم معرفة أنّ المواد قد تطرأ عليها تغيرات لا تنطوى على تفاعلات كيميائية على سبيل المثال فكّر في الماء الظاهر حيث تمر المياه بتغير فيزيائي يؤدي التغير الفيزيائي إلى تغيّر في شكل المادة و ليس في تركيبها، فالماء يظل ماء قبل التغير و بعده.
كيف تعرف بحدوث تفاعل كيميائي؟ على الرغم من أنّك قد لا تكون على دراية بكل التفاعلات التي تحدث داخل جسمك، إلا أنك تعلم أنّ سطح السلسلة قد تغيّر، فالجسم الذى كان فضياً و لامعاً أصبح الآن بنياً مائلًا إلى البرتقالي، و من الأدلة الأخرى على حدوث تفاعل كيميائي إنتاج حرارة أو ضوء و تكوّن غاز جديد أو سائل جديد أو مادة صلبة جديدة.
درس لمادة الأحياء بعنوان التفاعلات الكيميائية
عرض توضيحي
التغيّر الكيميائي مقابل التغيّر الفيزيائي وضّح أوجه الاختلاف بين التغيّرات الفيزيائية و التفاعلات الكيميائية باستخدام ثلاث أوراق، أحضر ورقة محروقة مسبقاً إلى الصف و اطوِ إحدى الأوراق و أنشئ فتحة فى وسط الورقة الثالثة. اشرح أن التفاعلات الكيميائية تحدث عندما تتكسّر الروابط فى مركب واحد أو أكثر من المركبات و تتكوّن روابط جديدة، فالاحتراق تفاعل كيميائي: أما الطي و القطع فتغيرات فيزيائية. ناقش الأمثلة و امنح الطلاب فرصة ليدافعوا عن الحجج التي يقدمونها.
الوقت المقدّر: 5 دقائق
المعادلات الكيميائية
عند كتابة العلماء للتفاعلات الكيميائية يعبرون عن كل مكوّن من مكوّنات التفاعل فى معادلة كيميائية ففي المعادلات الكيميائية المكتوبة، تصف الصيغ الكيميائية المواد مع أسهم تشير إلى عملية التغير.
المتفاعلات و المنتجات تظهر المعادلة الكيميائية المتفاعلات أي المواد الكيميائية يبدأ التفاعل بها، على يسار السهم و تظهر النواتج، أي المواد الكيميائية المتكوّنة أثناء التفاعل على يمين السهم و عند قراءة المعادلة نقول عوضاً عن السهم "يعطي" أو "يتفاعل ليكون"
المتفاعلات ----> النواتج
يمكن كتابة المعادلة الكيميائية التالية لوصف التفاعل الذي يوفر الطاقة للاعبي كرة الطائرة:
C6H12O6 + O6 ----> CO2 + H2O
يتفاعل الجلوكوز مع الأكسجين لتكوين ثاني أكسيد الكربون و الماء
المعادلات المتوازنة
في التفاعلات الكيميائية لا يمكن استحداث مادة أو إفناؤها، يُطلّق على هذا المبدأ اسم قانون حفظ الكتلة لذا يجب أن تظهر جميع المعادلات الكيميائية هذا التوازن في الكتلة ما يعني أنّ عدد ذرات كل عنصر في المتفاعلات يجب أن يكون مساوياً لعدد ذرات العنصر نفسه في النواتج. و تستخدّم المعاملات لضمان تساوي عدد الذرات لكل عنصر في الطرفين.
C6H12O6 + 6O2 ---> 6CO2 + 6H2O
لكل عنصر، اضرب المعامل في الرمز السفلي، ترى في هذا المثال أنه يوجد ست درات كربون واثتتي عشرة ذرة هيدروجين و ثماني عشرة ذرة أكسجين على كل من طرفي السهم. و تؤكد المعادلة تساوي عدد الذرات في كل من الطرفين و بالتالي تكون المعادلة موزونة.
درس بعنوان التفاعلات الكيميائية لطلاب الصف التاسع متقدم
التدريس المتمايز
دون المستوى ميِّز بين الدروس عندما يكون في الصف طلاب ذوو قدرات مختلفة. على سبيل المثال. يمكن تعديل النشاط الخاص بموازنة المعادلات الموضّح فى هذه الصفحة ليناسب الطلاب دون المستوى من خلال تقليل عدد المعادلات المطلوب منهم موازنتها.
طاقة التنشيط
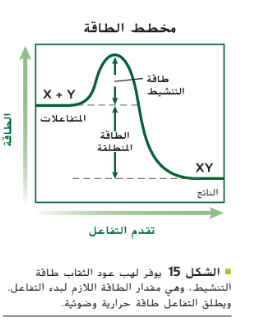
يُطلق هذا التعريف على الحد الأدنى من الطاقة اللازمة لكي تكوّن المتفاعلات نواتج في تفاعل كيميائي اسم طاقة التنشيط على سبيل المثال أنت تعلم أن الشمعة لن تحترق حتى تُشعل فتيليها أي إن اللهب يوفر طاقة التنشيط لتفاعل المواد الكيميائية فى فتيل الشمعة مع الأكسجين فى هذه الحالة.
بمجرد بدء التفاعل لا يعود بحاجة إلى المزيد من الطاقة و تستمر الشمعة في الاحتراق من تلقاء نفسها، يبيّن التمثيل البياني في الشكل 15 أنّ طاقة التنشيط أساسية لبدء التفاعل لكي تكوّن المتفاعلات X , Y الناتج XY يلزم وجود طاقة لبدء التفاعل. و تمثل قمة التمثيل البياني مقدار الطاقة الذي يجب إضافته إلى النظام لكي لإطلاق التفاعل. تجدر الإشارة إلى أنّ بعض التفاعلات نادرًا ما تحدث لأنها تحتاج إلى مقدار كبير للغاية من طاقة التنشيط.
درس التفاعلات الكيميائية لطلاب الصف التاسع متقدم الفصل الأول
تغير الطاقة فى التفاعلات الكيميائية
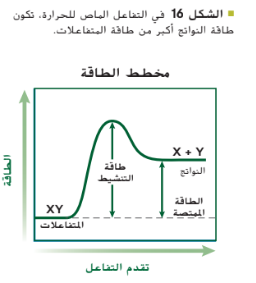
قارن بين كيفية تغير الطاقة أثناء التفاعل المبيّن فى التمثيل البياني فى الشكل 15 والتفاعل المبيّن فى التمثيل البيانى في الشكل 16. يحتاج التفاعلان إلى طاقة تنشيط كي ينطلقا لكن في التفاعل المبيّن في الشكل 15. يكون للناتج طاقة أقل مما للمتفاعلات. فهو تفاعل طارد للحرارة.
أي يطلق الطاقة على شكل طاقة حرارية في حين أن التفاعل المبيّن في التمثيل البياني في الشكل 16 هو ماص للحرارة أي يحدث فيه امتصاص لطاقة حرارية و يكون للناتج طاقة أكبر مما للمتفاعلات في كل تفاعل كيميائي يحدث تغيّر في الطاقة نتيجة تكوّن الروابط الكيميائية أو تكسّرها أثناء تكوين المتفاعلات من النواتج تحاول التفاعلات الطاردة للحرارة الحفاظ على درجة حرارة الجسم الداخلية عند حوالى 37 درجة مئوية.
الإنزيمات
إن الكائنات الحية مصانع كيميائية تحرّكها تقاعلات كيميائية. لكن حدوث هذه التفاعلات الكيميائية يكون بطيئاً للغاية عند تنفيذها فى المختبر لأن مقّدار طاقة التنشيط اللازم لها يكون كبيرًا. لكي تكون هذه التفاعلات الكيميائية مفيدة للكائنات الحية. يلزم وجود مواد إضافية أخرى في مكان حدوثها لتقلل من مقدار طاقة التنشيط اللازمة و لتسمح بتقدم التفاعل بسرعة.
الحقّاز مادة تقلل من مقدار طاقة التنشيط اللازمة لبدء التفاعل الكيميائي و على الرغم من أهمية الحفاز في تسريع التفاعل الكيميائي. إلا أنه لا يعمل على زيادة مقدار الناتج و لا يُستهلَك في التفاعل و يستخدم العلماء أنواعاً كثيرة من الحفازات لكى تحدث التفاعلات بشكل أسرع آلاف المرات مما لو حدثت من دونها.
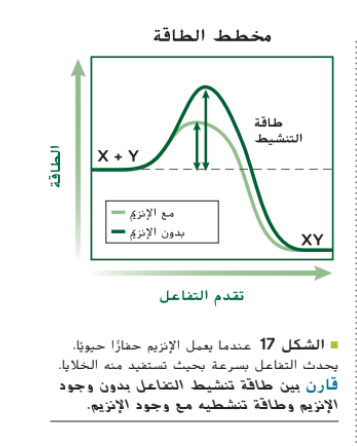
تُعدَ بروتينات خاصة تسمى الإنزيمات حفازات حيوية تزيد من سرعة التفاعلات الكيميائية في العمليات الحيوية، فالإنزيمات ضرورية للحياة، قارن بين تقدم التفاعل مبيّن فى التمثيل البياني في الشكل 17 لمعرفة تأثير الإنزيم فى التفاعل الكيميائي.
الإنزيم كأي حفاز لا يُستهلك في التفاعل الكيميائي و يمكن استخدامه مرة أخرى بعد مساهمته فى أي تفاعل كيميائي.