تلخيص كيمياء صف حادي عشر عام فصل أول
اسهامات العالم أنتوني لافوازييه (1743 - 1794)
1. أول من وضع جدول يضم العناصر المعروفة وكانت 33 عنصراً
2. رتب هذه العناصر إلى 4 فئات حسب الصفات الكيميائية والفيزيائية
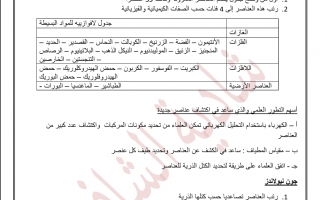
جدول لاقوازبيه للمواد البسيطة
الغازات :
الفلزات : الأنتيمون - الفضة - الزرنيخ - الكوبالت - النحاس - القصدير - الحديد - المنجنيز - الزئيق - الموليبدنيوم - النيكل الذهب - البلاتينيوم – الرصاص - التنجستين - الخارصين
اللافلزات : الكبريت - الفوسفور - الكربون - حمض الهيدروكلوريك – حمض الهيدروفلوريك - حمض البوريك
العناصر الأرضية : الطباشير - الماغنسيا - البورات
أسهم التطور العلمي والذي ساعد في اكتشاف عناصر جديدة
أ- الكهرباء باستخدام التحليل الكهربائي تمكن العلماء من تحديد مكونات المركبات واكتشاف عدد كبير من
العناصر .
ب – مقياس المطياف : تساعد في الكشف عن العناصر و تحديد طيف كل عنصر .
ج - اتفق العلماء على طريقة لتحديد الكتل الذرية للعناصر .
جون نيولاندز
1. رتب العناصر تصاعدياً حسب كتلتها الذرية .
2. أكتشف قانون الأوكتافات ( الثمانيات ) : عندما لاحظ أن الخواص تتكرر دوريا لكل ثمانية عناصر مثل الأوكتاف الموسيقي.
3. فشل قانون الثمانيات لتعذر تطبيقه على جميع العناصر المعروفة حينه .
لوثر ماير :
- رتب العناصر حسب الكتلة الذرية التصاعدية .
- وضح وجود علاقة بين الكتلة الذرية و صفات العناصر .
ديمترى مندلييف
1. رتب العناصر في جدول دوري حسب الكتلة الذرية التصاعدية .
2. وضح أن صفات العناصر تتكرر بصورة دورية .
3. وضح العلاقة بين الكتلة الذرية و خصائص العناصر .
4. تنبأ بوجود العناصر وخصائصها لم تكن موجودة في ذلك الوقت وترك مساحة فارغة في الجدول
الدوري
الترتيب الإلكتروني
الأنظمة ذات الطاقة المنخفضة أكثر استقرارا من الأنظمة ذات الطاقة العالية ولذلك تميل الإلكترونات لاتخاذ ترتيب يعطي الذرة اقل طاقة ممكنة .
لا تحتوي ذرات العناصر المختلفة على أعداد متساوية من الإلكترونات .
التوزيع الإلكتروني : ترتيب الإلكترونات في الذرة
مبدأ أوفباو : يشغل الإلكترون المستوى ذو الطاقة المنخفضة ( الأقل طاقة ) .
مبدأ الاستبعاد لباولي : الفلك الذري الواحد يشغله إلكترونان فقط كحد أقصى ولكن فقط إذا كانت الإلكترونات .
قاعدة هوند : لا يحدث تزاوج بين إلكترونين في تحت مستوى معين إلا بعد أن تشغل أفلاكه فرادى أولاً .
الترميز الإلكتروني :
يعبر عن مستوى الطاقة الرئيس والمستويات ( الثانوية )الفرعية المرتبطة مع كل المستويات الفرعية في الذرة .
المخطط المداري (الترميز بالفلك): يعبر عن عدد افلاك كل مستوى فرعي حيث فلك 5 يتسع لإلكترونان فقط
أفلاك P وهم 3 أفلاك تتسع ل 6 الكترونات فقط
أفلاك d وهم 5 أفلاك تتسع ل 10 الكترونات فقط
أفلاك f وهم 7 أفلاك تتسع ل 14 الكترونات فقط
تلخيص كيمياء صف حادي عشر عام فصل أول 2019
أيونات الفلزات :
فلزات المجموعة الأولى والثانية نشطة جدا لسهولة فقدها إلكترونات تكافؤها وتكون أيونات (+1 و+ 2 ) عن طريق فقد إلكترونات تحت المستوى ( s ) .
فلزات المجموعة 13 تكون أيونات (3 +) بفقد إلكترونات( s2p1) .
أيونات الفلزات الانتقالية
يمتلئ فيها تحت المستوى ns بالكامل و ndجزئيا أو تام الامتلاء
تفقد إلكترونات (ns ) أولا مكونة أيونات (+2) ثم تفقد إلكترونات (nd ) بدون قاعدة مكونة من +3 إلى +7
الغاز النبيل الكاذب أو الزائف :
هو اكتمال المستويات الفرعية s , d , pبالإلكترونات مما يعطي استقرار يشبه ترتيب الغاز النبيل
تكوين الأيون السالب ( الأنيون)
تكتسب ذرة اللافلز إلكترون أو أكثر لتصل لترتيب الغاز النبيل المقابل
ينتج عن تكوين الأيون السالب طاقة
تكوين الرابطة الأيونية:
الرابطة الأيونية هي تجاذب كهروستاتيكي بين أيونات الفلز الموجبة مع أيونات اللافلز السالبة
تتكون المركبات الأيونية من أيون فلز أو مجموعة ذرية بشحنة موجبة مع لافلز أو مجموعة ذرية بشحنة
سالبة .
يجب أن تتعادل الشحنات في المركب لنحصل على مركب أيوني متعادل الشحنة ( تساوي صفر)
يجب أولا تكوين الأيون الموجب والسالب ثم تبدأ في تكوين المركب لمعرفة عدد الأيونات منهما
عملية تكوين المركب الأيوني طاردة للطاقة
تمثيل طرق التكوين : بالمعادلة الكيميائية الترتيب الإلكتروني ترميز الفلك الترميز النقطي , النماذج الذرية
الخصائص الفيزيائية للمركبات الأيونية
التركيب الفيزيائي
1. تترتب الأيونات الموجبة والسالبة مع بعضها البعض بنسبة يحددها عدد الإلكترونات المنتقل من ذرة الفلز إلى اللافلز ( أي عدد الأيونات)
2. تترتب الأيونات في نمط متكرر منتظم صلب يعرف بالشبكة البلورية
3. الشبكة البلورية هي ترتيب هندسي ثلاثي الأبعاد يتضمن الأيونات المكونة للبلورة الأيونية
4. تتميز الشبكة البلورية بتوازن قوى الجذب والتنافر بين الأيونات المختلفة والمتشابهة مما يجعل شحنتها صفرا ولا توصل التيار الكهربائي في حالتها الصلبة .
من خلال دراسة الطبيعة البلورية يمكن التعرف على الخواص العامة مثل الصلابة ودرجة الانصهار
والغليان والخواص الكيميائية والمغناطيسية والكهربائية
تلخيص كيمياء صف حادي عشر عام فصل أول للعام 2019 - 2020
1. تنبأ موقع ذرات معينة.
تكون الذرة الأقل سالبيه كهربائية هي الذرة المركزية في الجزيء .
تقع الذرة المركزية العنصر في مركز الجزيء., كما أنه يحيط بها أكبر عدد من الذرات في الجزيء .وعليه فإن باقي
يكون الهيدروجين دائما ذرة طرفية؛ لأنه يشارك بزوج واحد من الإلكترونات» ويتصل بذرة واحدة فقط.
2.حدد عدد الإلكترونات المتوافرة لتكوين روابط؛ حيث يساوي هذا العدد الكلي لإلكترونات تكافؤ الذرات الموجودة في الجزيء
3.حدد عدد أزواج إلكترونات الربط .بقسمة عدد الإلكترونات المتوافرة للربط على 2
4.حدد أماكن أزواج الربط ضع رابطة واحدة بين الذرة المركزية و كل ذرة طرفية.
5.حدد عدد أزواج إلكترونات الترابط المتبقية بطرح عدد الأزواج المستخدمة في الخطوة الرابعة من العدد الكلي للأزواج في الخطوة الثالثة .
فتبين الأزواج المتبقية عدد الأزواج غير المترابطة والأزواج المستخدمة في الروابط الثنائية والثلاثية؛
ضع الأزواج غير المترابطة حول كل ذرة طرفية ( ما عدا الهيدروجين ) مرتبطة مع الذرة المركزية لتحقق
القاعدة الثمانية ثم ضع أي أزواج إضافية على الذرة المركزية.
6, حدد ما إذا كانت الذرة المركزية تحقق القاعدة الثمانية.
7. عندما لا تكون الذرة المركزية محاطة بأربعة أزواج من الإلكترونات فإنها لا تحقق القاعدة الثمانية و لتحقيق
القاعدة الثمانية حول زوجا أو زوجين من الأزواج غير المترابطة في الذرات الجانبية إلى رابطة ثنائية أو ثلاثية
بين الذرة الجانبية والذرة المركزية .
نظرية فيسبر : نموذج يبنى على اساس أن ترتيب الكترونات التكافؤ يحدث بحيث يكون تنافر الأزواج المشاركة وغير المشاركة في الترابط حول الذرة المركزية أقل ما يمكن
التهجين : عملية اندماج أكثر من فلك مختف في الشكل والطاقة في الذرة نفسها لتنتج أفلاكا مهجنة جديدة متماثلة في
الشكل ومتساوية في الطاقة .
الأفلاك المهجنة : أفلاك متساوية في الطاقة الناتجة من اندماج أكثر من فلكين للذرة .
زاوية الرابطة : هي الزاوية التي شكلتها أي ذرتين طرفيتين مع الذرة المركزية .
يؤثر زوج الإلكترونات الغير مرتبط ( الحر ) في المسافة بين أفلاك الروابط المشتركة حيث يحتل زوج الإلكترونات غير
المرتبط مساحة أكبر من زوج الإلكترونات المرتبط فتؤدي وجود زوج إلكترونات غير مرتبط لدفع أزواج الترابط
ليقترب بعضها من بعض كلما زاد عدد الالكترونات الحرة في الذرة المركزية للجزيء كلما زادت قوي التنافر بينها وبالتالي تقلل الزوايا بين أزواج الكترونات الرابطة
تلخيص كيمياء صف حادي عشر عام فصل أول