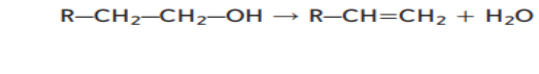نماذج أسئلة كيمياء ثاني عشر فصل ثالث اعتمادا على هيكل الاسئلة
_ أي من النماذج التالية توضح الشكل الهندسي للجزيء
أ - الضيغة الجزيئية
ب - نموذج ملء الفراغ
ت - الصيغة البنائية
ج - نموذج العصا و الكرات
_ أي من المركبات الواردة في الجدول ادناه يتفاعل مع البروم ؟
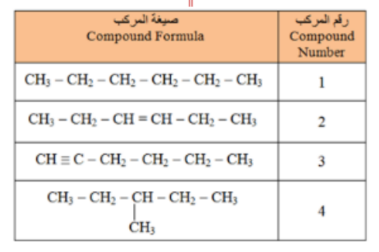
أ - المركب 1 فقط
ب - المركب 2 فقط
ت - المركبات 2 و 3 فقط
ج - الركبان 1 و 4 فقط
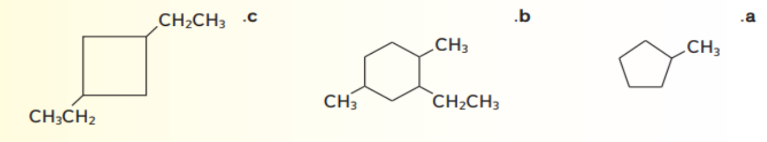
_ اي من المركبات الواردة في الجدول يعتبر هيدروكربون مشبع ؟
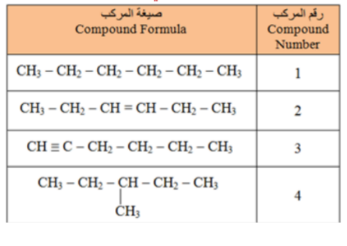
أ - المركب 1 فقط
ب - المركبان 2 و 3 فقط
ت - المركب 3 فقط
ج - المركبان 1 و 4 فقط
_ في برج التجزئة المستخدم في فصل مكونات النفط, اي الاجزاء يتم سحبها للخارج في المناطق الاكثر برودة بالقرب من اعلى البرج ؟
أ - الاجزاء ذات درجات الغليان الاقل
ب - الاجزاء ذات درجات الغليان الاعلى
ت - الاجزاء ذات الكتل الجزيئية الكبيرة
ج - الاجزاء ذات سلاسل الكربون الكبيرة
_ ما الترتيب الصحيح الذي تخرج به المركبات المذكورة في الجدول التالي عند تقطيرها من خليط ؟
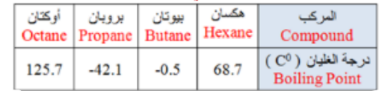
( إبدأ من المركب الاول في الفصل الى المركب الاخير )
أ - اوكتان - هكسان - بيوتان - بروبان
ب - هكسان - اوكتان - بروبان - بيوتان
ت - بروبان - بيوتان - هكسان - اوكتان
ج - اوكتان - بيوتان - بروبان - هكسان
_ في عملية التقطير التجزيئي للنفط
أ - يتم فصل المكونات اعتمادا على الاختالف في الخواص الكيميائية
ب - المكونات ذات درجات الغليان الاقل يتم سحبها من أسفل البرج.
ت - الزيوت و الشحوم التي لها درجات غليان أعلى تبقى بالقرب من أسفل البرج.
ج - يتم فصل المركبات ذات الكتل الجزيئية الصغيرة أسفل البرج.
_ تشترك ذرتي كربون في الرابطة الثنائية في الالكينات بـ
أ - الكترونات 6
ب - الكترون 2
ت - الكترونات 4
ج - الكترونات 8
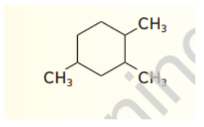
_ الاسم الصحيح للمركب الموضح في الشكل هو
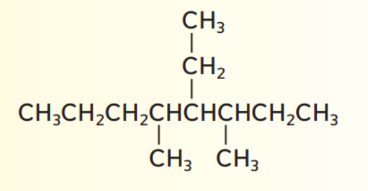
أ - 5 - ايثيل - 4 ,6 - ثنائي ميثيل أوكتان
ب - 4 - ايثيل - 5 , 3 - ثنائي ميثيل أوكتان
ت - 4 - ايثيل -5 , 3 - ثنائي ميثيل هبتان
ج - 5 - ايثيل - 4 , 6 - ثنائي ميثيل هبتان
_ الصيغة التي تمثل المركب
4 , 2 , 2 - ثلاثي ميثيل بنتان

8 - استخدم قواعد IUPAC لتسمية الصيغة البنائية الاتية :
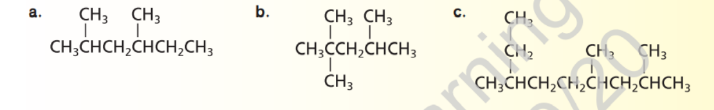
9 - تحدي ارسم الصيغ البنائية للالكانات التالية :
أ - 2 , 3 - ثنائي ميثيل 5 - بروبيل ديكان
ب - 3 , 4 , 5 - ثلاثي إيثيل اوكتان
10 - استخدم قواعد IUPAC لتسمية الصيغة البنائية الاتية :
11 - تدريب تحفيزي ارسم الصيغ البنائية للالكانات الحلقية الاتية :
أ - 1 - إيثيل - 3 - بروبيل بنتان حلقي
ب - 1 , 2 , 2 , 4 - رباعي ميثيل هكسان حلقي
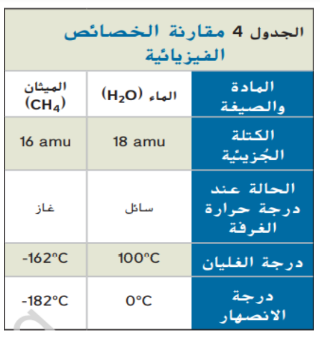
هذا الاختلاف في الجذب بالحقيقة التي تؤكد ان جزيئات الميثان غير قطبية و لا تشكل روابط هيدروجينية بعضها مع بعض بينما جزيئات الماء فهي قطبية و تشكل روابط هيدروجينية
كذلك يفسر الاختلاف في القطبية و تشكل الروابط الهيدروجينة سبب عدم قابلية امتزاج الالكانات و غيرها من اللهيدروكربونات مع الماء فإذا حاولت إذابة الالكانات مثل زيوت التشحيم في الماء فإن كلا السائلين بنفصلان على الفور الى طبقتين تقريبا يحدث هذا الفصل لان قوى التجاذب بين جزيئات الالكان اقوى من قوى التجاذب بين جزيئات الالكان و الماء و لذلك فإن الالكان تكون اكثر قابلية للذوبان في المذيبات التي تتكون من جزيئات غير القطبية مثل الالكانات نفسها مقارنة بعدد قابليتها للذوبان في الماء و هو مذيب قطبي
_ الخصائص الكيميائية للاكلنات الخاصية الكيميائية الرئيسة للالكانات هي انخفاض في النشاطية الكيميائية, تذكر ان العديد من التفاعلات الكيميائية تحدث عند جذب مادة متفاعلة ذات شحنة كهربائية كاملة مثل الايون, او ذات شحنة مضادة ان الجزيئات مثل الالكانات . التي ترتبط بها الذرات بواسطة روابط غير قطبية ليس لديها شحنة و نتيجة لذلك لديها قوة جذب منخفضة للايونات او الجزيئات القطبية كما يمكن عزو انخفاض قابلية التفاعل لدى الالكانات الى روابط C - C و H - C القوية نسبياً
12 - صف الخصائص البنائية الرئيسة لجزيئات الالكانات
13 - قم بتسمسة الصيغ التالية باستخدام قواعد IUPAC
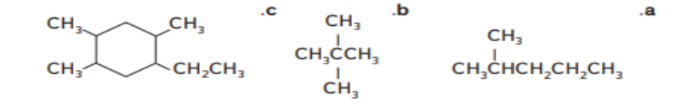
14 - صف الخصائص العامة للالكانات
15 - ارسم الصيغ البنائية لكل مما يلي
أ - 3 , 4 ثنائي الايثيل هبتان
ب - 4 - الايزوبروبيل - 3 - ميثيل ديكان
ت - 1 - إيثيل - 4 - ميثيل هكسان حلقي
ج - 1 , 2 - ثنائي الميثيل بروبان حلقي
16 - تفسير الصيغ البنائية لماذا يعد الاسم 3 - بيوتيل بنات غير صحيح ؟
استناداً الى هذا الاسم , اكتب الصيغة البنائية للمركب ما الاسم الصحيح ؟
3 - بيوتيل بنات بحسب قواعد IUPAC
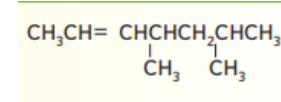
17 - استخدم قواعد IUPAC لتسمية الصيغة البنائية الاتية :
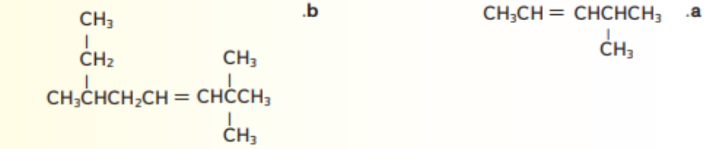
18 - تحدي ارسم الصيغة البنائية للمركب 1 ,3- بنتادايين
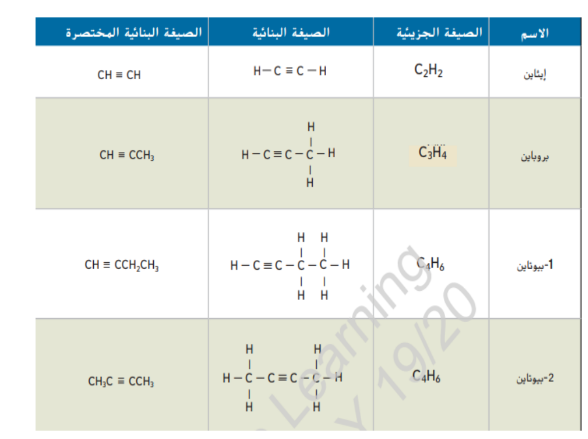
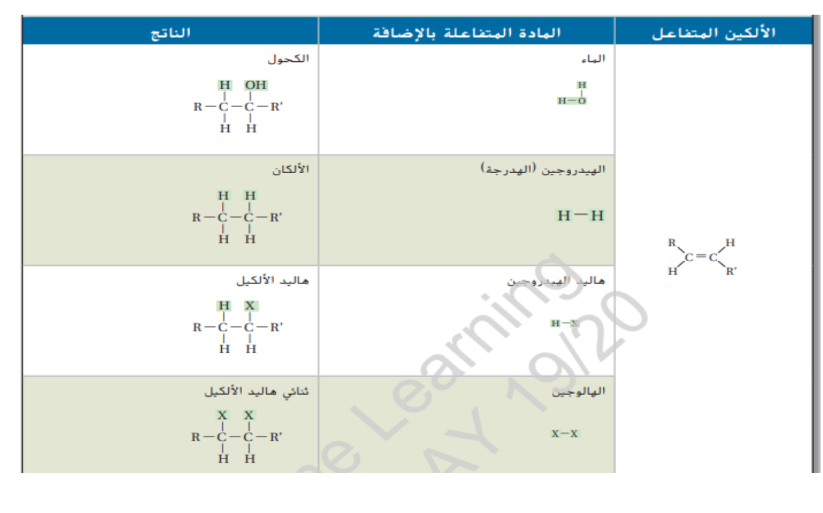
_ خصائص الالكاينات و استخداماتها تتميز الالكاينات بخصائص فيزيائية و كيميائية مشابهة لخصائص الالكينات تخضع الالكاينات للعديد من التفاعلات التي تخضع لها الالكينات مع ذلك تكون الالكاينات عادة اكثر نشاطاً من الالكينات لان الروابط الثلاثية للالكاينات فيها كثافة الكترونات اعلى مقارنة بالروابط الثنائية للالكينات ان هذه المجموعة من الالكترونات فعالة في تحفيز تكوين الاقطاب في الجزيئات المجاورة مما يتسبب في شحنها بشكل غير متماثل و بالتالي تصبح اكثر نشاطاً
يمثل الايثالين المعروف بالاسم الشائع الاسيتيلين منتجاً ثانوياً لتكرير النفط كما يتم إنتاجه أيضاً بكميات كبيرة عن طريق تفاعل كربيد الكالسيوم مع الماء عند إمداد الايثالين بما يكفي من الاكسجين فإنه يشتعل مولداً لهباً ساخناً كثيفاً بدرجات حرارة قد تصل الى 3000 درجة يتم استخدام لهب الاسيتيلين عادة في لحام الفلزات كما هو مبين في الشكل 16 نظراً لكون الرابطة الثلاثية تجعل الالكاينات متفاعلة فإن الالكاينات البسيطة مثل الايثاين تستخدم كمواد اولية في الالكاينات متفاعلة فإن الالكاينات البسيطة مثل الايثاين تستخدم كمواد اولية في الالكاينات متفاعلة فإن الالكاينات البسيطة مثل الايثاين تستخدم كمواد اولية في صناعة البلاستيك و المواد الكيميائية العضوية الاخرى المستخدمة في الصناعة .
19 - صف وجه / اوجه اختلاف كل من الصيغ البنائية للالكينات و الالكاينات عن البنئاية للالكانات
20 - حدد وجه / اوجه اختلاف الخواص الكيمائية لكل من الالكينات و الالكاينات عن الخواص الكيميائية للالكانات
21 - قم بتسمية النى المبينة مستخدماً قواعد IUPAC
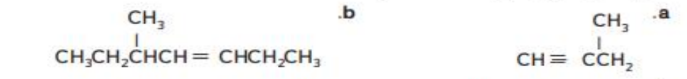
22 - ارسم الصيغة البنائية لكل من 4 - ميثيل - 1 ,3 - بينتادين و 2, 3 - ثنائي ميثيل - 2 - بيوتين
23 - استدل على كيفية مقارنة درجات الغليان و التجمد للالكاينات مقارنة بدرجات الغليان و التجميد للالكانات التي تحتوي على نفس عدد ذرات الكريون , اشرح استنتاجك ثم ابحث في البيانات لمعرفة ما إذا كانت تدعم فكرتك
24 - توقع اي ترتيب هندسي تتوقع من الروابط المحيطة بذرة كربون في كل من الالكانات و الالكينات و الالكاينات ؟
( تلميح : يمكن استخدام نظرية تنافر ازواج إلكترونات التكافؤ لتوقع الشكل )
_ ثلاثة من الصيغ البنائية الواردة في الجدول ادناه هي ايزومرات بنائية لبعضها البعض, ما الصيغة التي لا تمثل ايزومراً بنائياً للمركبات الاخرى ؟
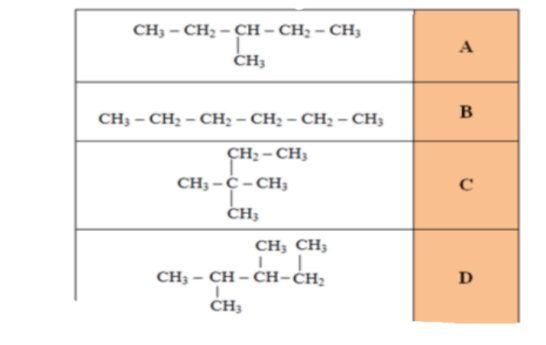
_ كلما ازداد عدد ذرات الكربون في الهيدروكربون ازداد ايضاً عدد الايزومرات البنائية المحتملة على سبيل المثال , هناك تسعة الكانات لها الصيغة الجزيئية ( C7H16 ) و هناك اكثر من 300000 ايزومر بنائي لديه الصيغة ( C20H42 )
الشكل 17 : ان هذه المركبات التي لها الصيغة الجزيئية نفسها C5H12
هي ايزومرات بنائية , لاحظ الاختلاف في درجات غليانها
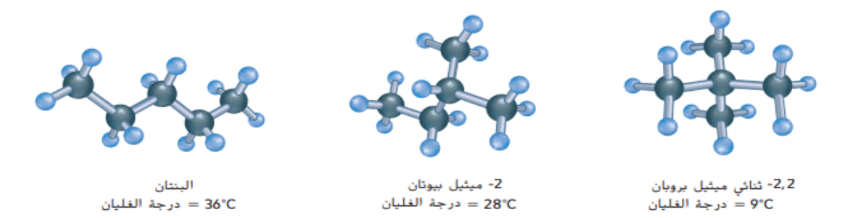
_ الشكل 18 : ان ذرات الكربزن ذات الرابطة الاحادية في الايثان لها حرية الدروان حول الرابطة بينما تقاوم ذرات الكربون ذات الرابطة الثنائية في الايثين حركة الدوران.
أشرح : كيف تعتقد ان هذا الاختلاف في القدرة على الدوران من شأنه ان يؤثر على الذرات او مجموعات الذرات المرتبطة مع ذرات الكربون ذات الرابطة الاحادية و ذرات الكربون ذات الرابطة الثنائية ؟
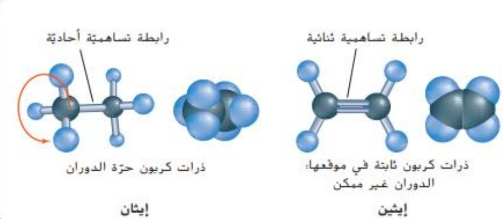
_ الشكل 19 : تختلف ايزومرات 2 - بيوتين في الترتيب داخل الحيز الفراغي لاثنين من مجموعات الميثيل على الاطراف لا يمكن لذرات كربون الرابطة الثنائية ان تدور بعضها مع بعض لذلك ثبتت مجموعات الميثيل في احد هذين الترتيبين
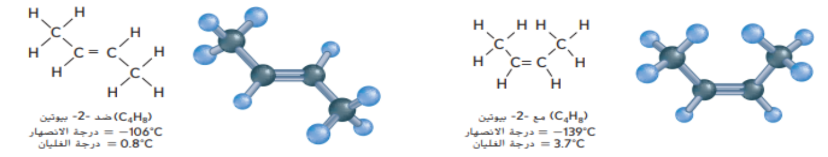
فيما يتعلق بالمركبات الواردة في الجدول ادناه .
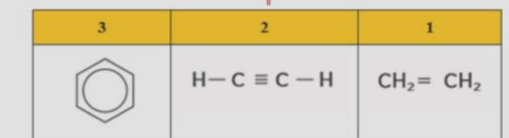
أي العبارات التالية صحيحة ؟
أ - المركبات 1 و 2 هيدروكربونات أليفاتية منخفضة النشاطية
ب - المركبان 1 و 2 هيدروكربونات آروماتية منخفضة النشاطية
ت - المركب 3 هيدروكربون آروماني خامل الى حد ما
ج - المركب 3 هيدروكربون آروماني غير مستقر و متفاعل لاقصى درجة
_ نموذج حديث للبنزين : منذ اقتراح كيكوليه, اكدت الابحاث ان التركيب الجزيئي للبنزين سداسي الشكل فعلاً ومع ذلك لم يتمكن احد من شرح عدم تفاعلية البنزين حتى 1930 حينما اقترح لينوس بولينغ نظرية الافلاك المهجنة و عند تطبيق هذه النظرية على البنزين تتنبأ هذه النظرية بأن ازواج الالكترونات التي تشكل الروابط الثنائية في البنزين لا تقع بين اثنين فقط من ذرات الكربون المحددة كما هو الحال في الالكينات و لكن ازواج الالكترونات لم توضع في موضعها الصحيح و هو ما يعني انها مشتركة بين جميع ذرات الكربون الست في موضعها الصحيح و هو ما يعني انها مشتركة بين جميع ذرات الكربون الست في الحلقة الشكل 25 يدل على ان هذا الموضع يجعل جزيء البنزين مستقر كيميائياً لانه من الصعب شد الالكترونات المشتركة في ست نويات كربون بعيداً مقارنة بالالكترونات المرتبطة بنواتين فقط عادة لا يتم الاشارة الى رات الهيدروجين الست , و لكن من المهم تذكر انها موجودة و في هذا التوضيح ترمز الدائرة الموجودة في منتصف الشكل السداسي الى السحابة التي شكلها ثلاثة ازواج من الالكترونات
_ الاسم الصحيح للمركب التالي هو
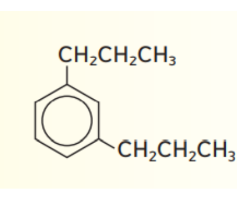
أ - 4، 2 – ثنائي ايثيل بنزين
ب - 1، 3 – ثنائي ايثيل بنزين
ت - 4، 2 – ثنائي بروبيل بنزين
ج - 1، 3 – ثنائي بروبيل بنزين
31 - حدد اسم المركبات التالية :
32 - التحدي : ارسم الصيغة البنائية 1, 4 - ثنائي ميثيان بنزين
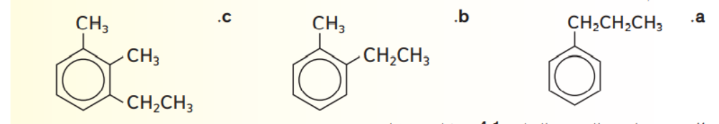
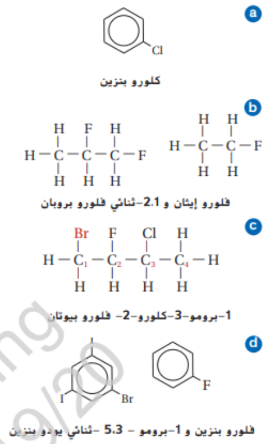
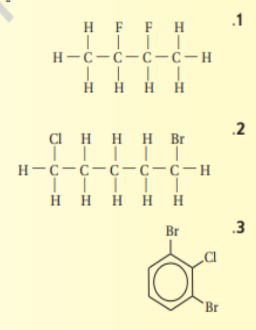
33 - سم المركبات هاليد الالكيل او الاريل التي لها الصيغ البنائية التالية :
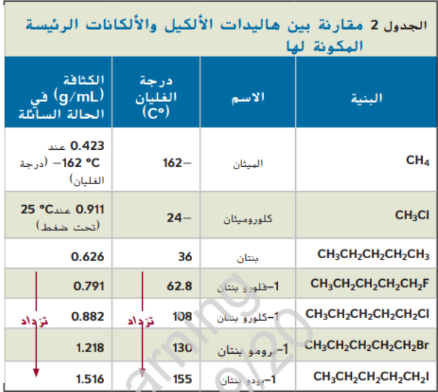
_ خواص هاليدات الالكيل و استعمالاتها
عند دراستك خصائص المركبات العضوية التي تحتوي على مجموعات وظيفية من الاسهل لك مقارنتها مع الالكانات المقابلة لها و التي تكون تعرف خصائصها مسبقاً لاحظ في الجدول 2 ان كل هاليد ألكيل له درجة غليان و كثافة اعلى من الالكان الذي له ذرات الكربون نفسها و لاحظ ايضاً زيادة كل من درجة الغليان و الكثافة عند الانتقال من الفلور الى الكلور و البروم و اليود و يرجع السبب في ذلك لانه عند الانتقال من الفلور الى اليود يزداد عدد الالكترونات البعيدة عن النواة في الهالوجين و تغير هذه الالكترونات مكانها بسهولة و نتيجة لذلك تكون هاليدات الالكيل اقطاب مؤقتة و لان الاقطاب تتجاذب معاً فإن الطاقة اللازمة لفصل الجزيئات بعضها عن بعض تزداد ايضاً و بذلك درجة الغليان بزيدة حجم ذرة الهالوجين
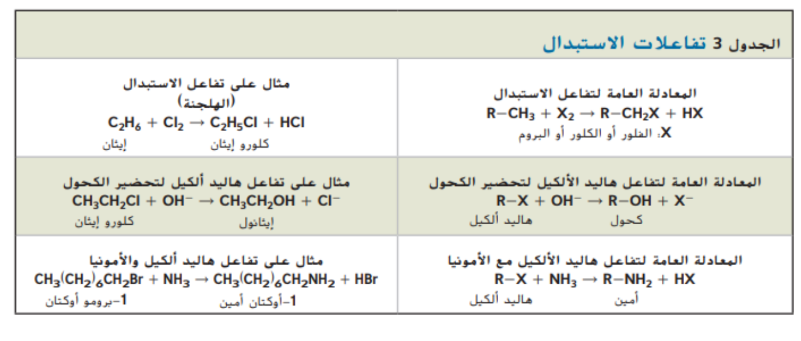
الكحولات
تحتوي الكثير من المركبات العضوية ذرات اكسجين مرتبطة مع ذرات كربون و لان ذرات الاكسجين لديها ستة الكترونات تكافؤ فهي تشكل على الاغلب رابطتين تساهميتين لتحصل على استقرار ثماني كما يمكن لذره الاكسجين ان تشكل رابطة ثنائية مع ذرة كربون مستبدلة ذرتي هيدروجين او يمكن ان تشكل رابطة احادية مع ذرة كربون و رابطة احادية اخرى مع ذرة اخرى مثل الهيدروجين و تسمى المجموعة الوظيفية المكونة من اكسجين - هيدروجين و التي ترتبط تساهمياً مع ذرة كربون مجموعة هيدروكسيل و المركب العضوي الذي تستبدل فيه ذرة هيدروجين من الهيدروكربون بمجموعة هيدروكسيل ( OH_ ) يسمى الكحول , و يبين الجدول 4 الصيغة العامة للكحولات و هي ( ROH ) و يوضح العلاقة ما بين ابسط ألكان و هو الميثان و بين ابسط الكحولات و هو الميثانول .
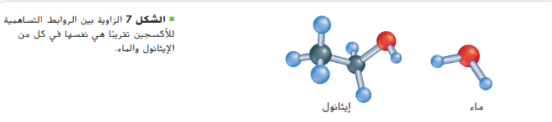
ينتج الايثانول و ثاني اكسيد الكربون بواسطة الخميرة عند تخمير السكريات . كالموجودة في العنب و ينتج ثاني اكسيد الكربون ايضاً من تحمر عجين الخبز و يدخل الايثانول في المنتجات الطبية و يستعمل لتطهير الجلد قبل اعطاء الحقن و يضاف الى الجازولين لزيادة فاعليته و يعد مادة اولية لصناعة مركبات عضوية اكثر تعقيداً . يظهر في الشكل 7 نموذج لجزيء الايثانول و تموذج اخر لجزيء الماء و اذا قارنتها ببعضها البعض ستلاحظ ان زاوية الارابطة التساهمية من الاكسجين في الايثانول تساوي تقريباً زاوية الرابطة التساهمية من الاكسجين في الماء لذا تكون مجموعة الهيدروكسيل في جزيئات الكحولات متوسطة القطبية كما في جزيئات الماء و كما يمكن ان يكون روابط هيدروجينية مع مجموعات هيدروكسيل في جزيئات كحول اخرى و بسبب هذه الروابط تكون درجة غليان الكحولات اعلى من درجة غليان الهيدروكربونات المماثلة لها بالشكل و الحجم .
و بسبب القطبية و الروابط الهيدروجينية يمتزج الايثانول مع الماء كليا و بمجرد امتزاجها يصعب فصلهما عن بعضهما البعض بصورة كاملة و نستعمل عملية التقطير بفصل اليثانول عن الماء و لكن حتى بعد إتمام العملية يبقى حوالي نسبة 5 % في صورة مزيج منهما
بسبب قطبية مجموعات الهيدروكسيل فإن الكحولات تعتبر مذببات جيدة للمركبات العضوية القطبية الاخرى و على سبيل المثال يستعمل الميثانول و هو ابسط الكحولات في صناعة مزيلات الطلاء و يستعمل 2 - بيوثانول في صناعة الاصباغ و الورنيش
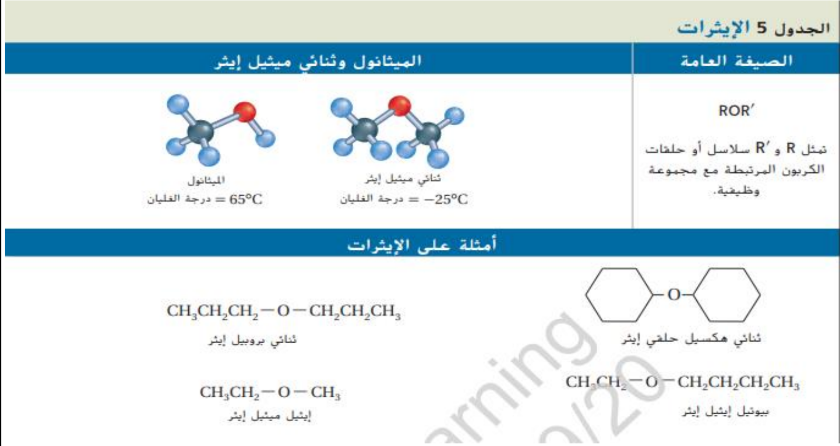
تسمى الكحولات بالاعتياد على الالكانات المقابلة لها كما في هاليدات الالكيل فمثلاً ( Ch4 ) هو ميثان و ( CH3OH ) ميثانول و ( CH3CH3 ) إيثان و ( CH3CH2OH ) ايثانول و تعتمد تسمية الكحولات البسيطة على عدد ذرات الكربون في سلسة الالكان المقابل لها و تنص قواعد التسمية بالنظام العالمي IUPAC على ان يتم تسمية الالكان اولا و من ثم اضافة المقطع ( ـــ ول ) للاشارة الى وجود مجموعة الهيدروكسيل و عندما تتكون الكحولات من ثلاث ذرات كربون او اكثر . يجب الاشارة الى موقع مجموعة الهيدروكسيل برقم , كما هو مبين في الشكل a8 و b8
_ ملخص القسم
_ تتشكل الكحولات و الايثرات و الامينات عندما يستبدل هيدروجين بمجموعة وظفية محددة في الهيدركربونات
_ بسبب قدرتها على تشكيل روابط هيدروجينية لدى الكحولات درجة غليان و قابلية للذوبان في الماء اعلى من بقية المركبات العضوية
9 - حدد عنصران غالبا ما يوجدان في المجموعات الوظيفية .
10 - حدد المجموعة الوظيفية الموجودة في كل من الصيغ البنائية التالية ,قم بتسمية المادة المبينة في ككل صيغة
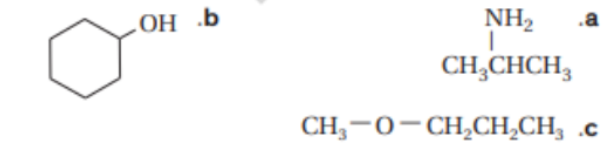
11 - ارسم الصيغ البنائية لكل من :
أ - 1 - بروبانول
ب - 1, 3 - بناتن ديول حلقي
ت - ايثيل بروبيل ايثر
ج - 1, 2 - بروبان ثنائي امين
12 - ناقش خصائص الكحولات و الايثرات و الامينات و اعط استخداماً لكل منها
13 - حلل اعتماداً على الصيغ البنائية ادناه اي من المركبات تتوقع ان يكون اكثر قابلية للذوبان في الماء ؟ فسر اجابتك .

الامينات :
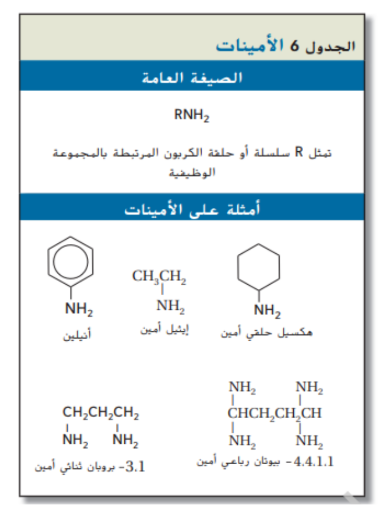
الامينات تحتوي على ذرة نيتروجين واحدة او اكثر مرتبطة مع ذرات كربون ففي سلاسل أليفاتية او حلقات اروماتية و لها الصيغة العامة ( RNH2 ) و ( ArNH2 ) كما يظهر في الجدول 6
اشتق الكيميائيون اسم الامينات من الامونيا ( NH3 ) و نصنف الامينات الى اولية او ثانوية او ثالثية بحسب ما اذا كانت ذرة هيدروجين واحدة او اثنان او ثلاثة في الامونيا حل محلها مجموعة مضوية
عند تسمية الامينات يتم الاشارة الى مجموعة الامين ( _NH2 ) باضافة المقطع امين الى نهاية الاسم و احيانا يكون من الضروري الاشارة الى موقع مجموعة الامين برقم كما يبين الجدول 6 و ان كان هناك اكثر من مجموعة امين يستخدم المقطع “ ثنائي ” او “ ثلاثي ” او رباعي " في بداية الاسم ليدل على عدد مجموعات الامين
يستخدم الانيلين في صناعة الاصباغ غامقة اللون و الاسم الشائع “ انيلين ” مشتق من اسم النبات الذي نحصل عليه منه كما ان الهكسيل الحلقي امين و الايثيل امين مهمان في انتاج المبيدات الحشرية و البلاستيك و المستحضرات الدوائية و المطاط المستخدم في صناعة الاطارات
و رائحة الامينات المتطايرة كريهة و غير مقبولة للانسان و الامينات هي المسؤولة عن الروائح الكريهة الميزة للكائنات الميتة و المتحللة و غالباً ما تستعمل الكلاب البوليسية المدربة
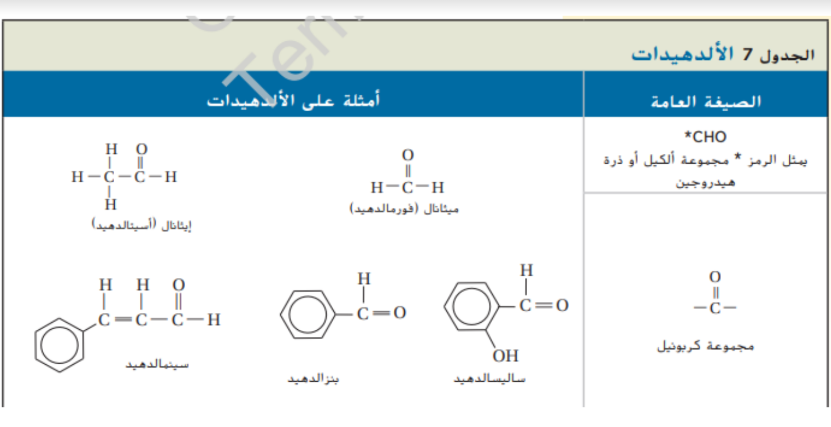
يكون جزيء الالدهيد قطبي و نشط و لكن كما في الايثرات لا يمكن لجزيئات الالدهيد ان تشكل روابط هيدروجينية بين بعضها البعض لانها لا تحتوي على ذرة هيدروجين مرتبطة مع ذرة اكسجين لذلك درجة غليان الالدهيدات اقل من الكحولات التي تحتوي على نفس عدد ذرات الكربون و كما يمكن ان تشكل الالدهيدات روابط هيدروجينية مع ذرات الاكسجين في جزيئات الماء لذلك الالدهيدات اكثر قابلية للذوبان في الماء من الالكانات و لكن ليس بنفس درجة الكحولات و الامينات
كان يستخدم الفورمالدهيد لحفظ اجسام الكائنات الميتة لعدة سنوات كما يظهر في الشكل 9 و صناعياً يستعمل الفورمادهيد للتفاعل مع اليوريا لانتاج نوع من البلاستيك المقاوم الذي يستعمل في صناعة قطع السيارات و الازرار و الاجهزة الكهربائية كما يستعمل الفورمالدهيد في صناعة الغراء الذي يستعمل في لصق قطع الخشب معا و المركبان بنزالدهيد و ساليسيلالدهيد الموضحين في الجدول 7 هما المسؤلين عن نكهة اللوز الطبيعية اما رائحة القرفة و مذاقها - و هي نوع من التوابل يستخرج من شجرة استوائية - فيمكن انتاجها تنتج بكميات كبيرة السنمالدهيد كما يبين الجدول 7
_ التأكد من فهم النص : حدد استخدامين للالدهيدات
_ الكيتونات
الكيتونات : قد تقع مجموعة الكربونيل ضمن سلسلة الكربون بدلا من نهايتها و يتكون الكيتون و هو مركب عضوي ترتبط فيه ذرة الكربون الموجودة في مجموعة الكربونيل مع ذرتي كربون اخرتين و الصيغة العامة للكيتونات موضحة في الجدول 8 و كما قد ترتبط ذرتا الكربون على كل من جهتي رابطة الكربونيل بذؤات كربون اخرى و من ابسط الكيتونات و اكثرها شيوعاً الاسيتون حيث ترتبط ذرات كربون على طرفي مجموعة الكربونيل بذرات الهيدروجين فقط كما يبين الجدول 8 و عند تسمية الكيتونات يتم اضافة المقطع ( _ ون ) الى اسم الالكان و وضع رقم قبل الاسم للاشارة الى موقع مجموعة الكربونيل فعلى سبيل المثال اسم الالكان بروبان يصبح بروبانون و لا يوضع رقم قبل الاسم لان مجموعة الكربونيل تقع فقط في المنتصف في هذه الحالة و لكن يمكن وضع رقم 2 قبل الاسم لمزيد من التوضيح كما يظهر في الجدول 8
تشترك الكيتونات و الالدهيدات في العديد من الخصائص الفيزيائية و الكيميائية بسبب تشابه بنيتهما الكيتونات جزيئات قطبية و لكنها اقل نشاط من الالدهيدات لهذا السبب تعتبر الكيتونات مذيبات جيدة للمركبات العضوية متوسطة القطبية و منها الشموع و البلاستيك و الدهان و الطلاء و الورنيش و الغراء و كما هو الحال في جزيئات الالدهيدات, لا يمكن لجزيئات الكيتون ان تشكل روابط هيدروجينية مع بعضها لكن يمكنها ان تشكل روابط هيدروجينية مع جزيئات الماء لذلك تعتبر الكيتونات قابلة للذوبان في الماء نسبياً اما الاسيتون فيذوب كلياً في الماء
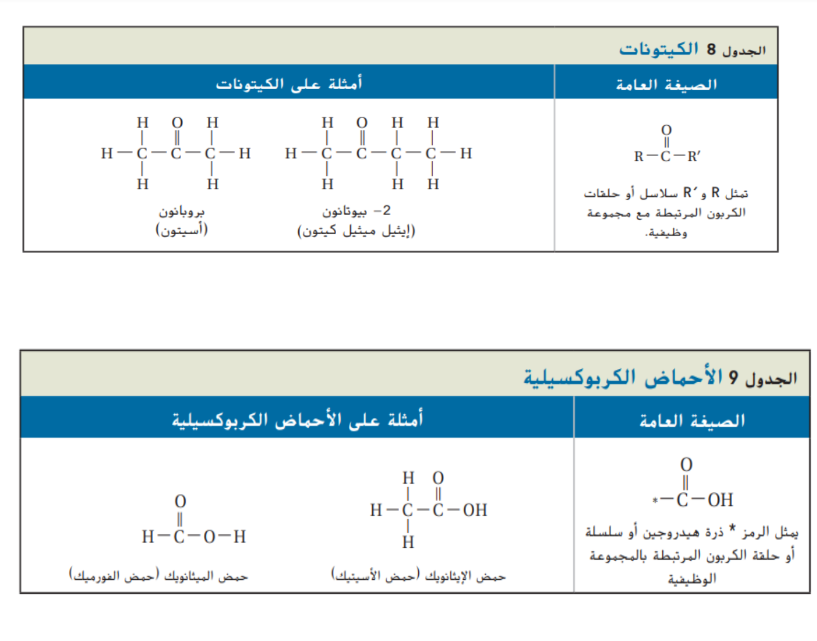
الاحماض الكربوكسيلية
الاحماض الكربوكسيلية قطبية و نشيطة و تتأين في الماء بشكل ضعيف و ينتج عن تأينها ايونات الهيدرونيوم و ايونات الحمض و التي تكون في وضع اتزان مع الماء و الحمض غير المتأين فعلى سبيل المثال بتأين حمض الايثانويك كما في المعادلة التالية :
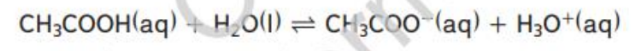
ايونات الهيدرونيوم ايونات الايثانوات ( الاسنات ) حمض الايثانويك ( حمض الاسيتيك ) يمكن ان تتأين الاحماض الكربوكسيلية في الماء لان ذرتي الاكسجين ذات سالبية كهربائية عالية و تجذب الالكترونات بعيدا عن ذرة الهيدروجين في مجموعة ( OH _ ) و نتيجة لذلك يمكن ان ينتقل البروتون ( الهيدروجين ) الى ذرة اخرى يكون لديها زوج من الالكترونات غير المرتبطة مثل ذرة الاكسجين في جزيء الماء و لان الاحماض الكربوكسيلية تتأين في الماء فإن محاليلها تحول لون ورقة تباع الشمس من الازرق الى الاحمر كما ان لها طعم حمضي لاذع
و تحوي بعض الاحماض الكربوكسيلية المهمة مثل حمض الاوكساليك و حمض الاديبيك على مجموعتين او اكثر من المجموعات الكربوكسيلية و الحمض الذي يحوي على مجموعتين او اكثر من المجموعات الكربوكسيلية و الحمض الذي يحوي على مجموعتين كربوكسيليتين يسمى حمض ثنائي الكربوكسيل وقد تحوي الاحماض الاخرى على مجموعات وظيفية اضافية مثل مجموعة الهيدروكسيل و قد تحوي الاحماض الاخرى على مجموعات وظيفية اضافية مثل مجموعة الهيدروكسيل كما في حمض اللاكتيك الموجود في اللبن و غالباً تكون هذه الاحماض اكثر قابلية للذوبان في الماء و اكثر حمضية من الاحماض التي تحوي على مجموعة كربوكسيلية واحدة
_ التأكد من فهم النص : قيم مستخدماً المعلومات اعلاه , اشرح لماذا تصنف الاحماض الكربوكسيلية على انها احماض


المركبات العضوية المشتقة من الاحماض الكربوكسيلية
للكثير من فئات المركبات العضوية صيغة بنائية لحمض كربوكسيلي استبدلت فيها ذرة الهيدروجين او مجموعة الهيدروكسيل بذرة اخرى او مجموعة من الذرات و من اكثرها شيوعاً الاستر و الاميدات
_ الاسترات
الاستر : هو مركب عضوي يحتوي على مجموعة كربوكسيل , استبدلت ذرة الهيدروجين فيها مجموعة الكيل كما هو وضح في الجدول 10 و عند تسمية الاستر يكتب اسم الحمض الكربوكسيلي اولا ثم يستبدل المقطع ( ويك ) بالمقطع ( وات ) متبوعا بمجموعة الالكيل كما هو موضح في الجدول 10 لاحظ الاسم بروبيل ينتج من الصيغة البنائية , يعتمد الاسم الظاهر في الاقواس على الاسم حمض الاستيك , الاسم الشائع لحمض الايثانويك
الاسترات هي جزيئات قطبية و العديد منها متطاير و ذو رائحة عطرة و يوجد الكثير منها في الروائح و النكهات الطبيعية للازهار و الفواكه كما يظهر في الشكل 11 تنتج النكهات الطبيعية _ مثل الموز و التفاح - عن خليط من جزيئات المركبات العضوية و منها الاستر و بعض هذه النكهات قد يكون بسبب تركيب استر واحد لذا تستعمل الاسترات في النكهات و المشروبات و العطور و الشموع المعطرة و المواد المعطرة الاخرى
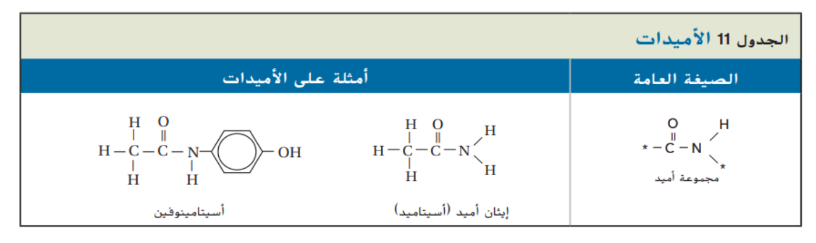
_ الاميدات :
الاميد : هو مركب عضوي يحتوي على مجموعة كربوكسيل استبدلت فيها مجموعة الهيدروكسيل ( OH_ ) بذرة نيتروجين مرتبطة مع ذرات اخرى و الصيغة العامة للاميدات مبينة في الجدول 11 و نسمي الاميدات بكتابة اسم الالكان الذي له عدد ذرات الكربون نفسها و يضاف المقطع “ اميد ” في نهاية الاسم لذلك يكون اسم الاميد المبين في الجدول 11 ايثان اميد و لكه يعرف بالاسم الشائع اسيتاميد المشتق من الاسم الشائع حمض الاسيتيك
_ التأكد من فهم النص : كيف يختلف الاميد عن الحمض الكربوكسيلي ؟
_ توجد مجموعة الوظيفية للاميد مكررة عدة مرات في البروتينات الطبيعية و في بعض المواد الصناعية لعلك تناولت مسكنات الم تحتوي اسيتامينوفين بدلا من الاسبرين
وبالنظر الى تركيبه المبين في الجدول 11 لاحظ انه يتكون من مجموعة ( ـــ NH ـــ ) مرتبطة مع مجموعة كربونيل و مجموعة آروماتية
و من اشهر الاميدات هو الكارأميد ( ) و الذي يعرف بالاسم الشائع يوريا و اليوريا هو اخر نواتج عملية هضم البروتينات في الثدييات و توجد في الدم و الصفراء و الحليب عند الثدييات و عندما تتكسر البروتينات تغادر مجموعات الامين منها و تتحول هذه المجموعات الامينية ( ) الى جزيئات امونيا ( ) و تعتبر سامة للجسم و تتحول الامونيا السامة الى يوريا في الكبد و تصفى اليوريا خارج الدم في الكليتين و تخرج من الجسم مع البول
و بسبب النسبة العالية من النيتروجين في اليوريا و سهولة تحويلها الى امونيا في التربة تستعمل اليوريا كسماد تجاري كما تستخدم اليوريا ايضاً كمصدر بروتيني للحيوانات العاشبة مثل الماشية و الاغنام اذ تستخدم هذه الحيوانات اليوريا لانتاج البروتين في اجسامها
_ التأكد من فهم النص : حدد احد الاميدات الموجودة في جسم الانسان
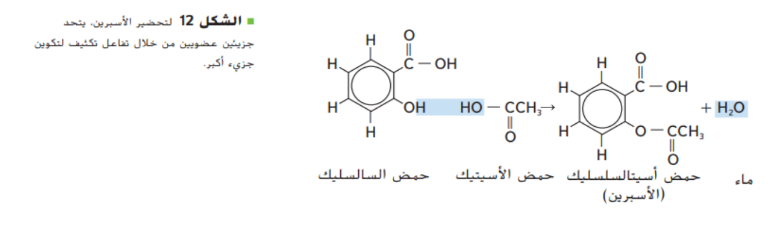
_ تفاعلات تكثيف
تتطلب عمليات تحضير المركبات العضوية في المختبرات و العمليات الصناعية تفاعل مادتين لانتاج ممركب عضوي جديد ضخم مثل الاسبرين المبين في الشكل 12 و يسمى هذا التفاعل تفاعل تكثيف
في تفاعل التكثيف يرتبط جزيئين عضويين صغيرين لتكوين جزيء عضوي اكثر تعقيدا و مصحوبا بجزيء صغير كالماء و ينتج الجزيء الصغير من كلا الجزيئين المتفاعلين و تعتبر تفاعلات التكثيف من تفاعلات الحذف حيث ترتبط فيه ذرتين لم يسبق لهما ان ارتبطا ببعضهما البعض و من اكثر تفاعلات التكثيف شيوعا تفاعلات الاحماض الكربوكسيسلة مع المواد العضوية الاخرى و الطريقة الشائعة لتحضير الاستر تتضمن تفاعل بين حمض كربوكسيلي و كحول يمكن التعبير عن مثل هذا التفاعل بالمعادلة العامة التالية :
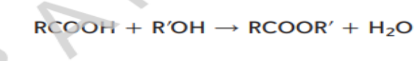
14 - صنف كلا من مركبات الكربونيل التالية الى احد انواع المواد العضوية التي درستها في هذا القسم
15 - صف : نواتج تفاعل التكثيف بين حمض الكربوكسيليك و الكحول
16 - حدد : الصيغة العامة للالكانات هي ( CnH2n+2 ) استنبط صيغا عامة لكل من الالدهيد و الكيتون و الحمض الكربوكسيلي
17 - استدل : لماذا تظهر المركبات العضوية الذائبة في الماء و التي تحتوي على مجموعات كربوكسيلية خصائص حمضية بينما لا تظهر مركبات اخرى مشابهة لها في التركيب مثل الالجهيد هذه الخصائص
يتم انتاج الايثين المادة الاولية لصناعة الادوات الموجودة في الملاعب كما هو موضح في الشكل 14 من خلال ازالة ذرتي هيدروجين من الايثان و يطلق على التفاعل الذي يتم فيه حذف ذرتي هيدروجين اسم تفاعل نزع الهيدروجين
لاحظ ان ذرتي الهيدروجين تكونان جزيء غاز الهيدروجين
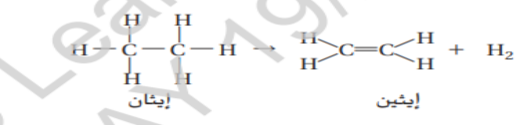
يمكن ان يخضع هاليد الالكيل لتفاعلات الحذف لانتاج الكين و هاليد الهيدروجين كما هو موضح هنا
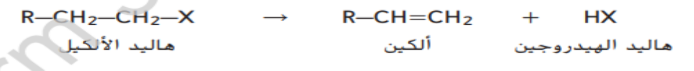
بالمثل يمكن ان تخضع الكحولات لتفاعلات الحذف عبر فقد ذرة هيدروجين و مجموعة هيدروكسيل لتكوين الماء كما هو موضح ادناه و يعرف تفاعل الحذف الذي تتم فيه إالة جزيئات من الماء باسم تفاعل نزع الماء و في هذا التفاعل يتحول الكحول الى الكين و ماء
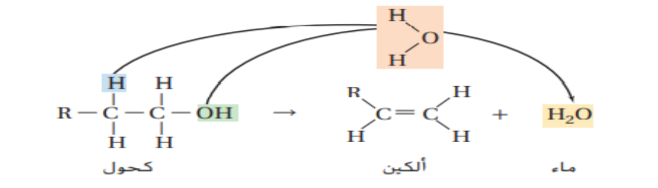
و تكتب الصيغة العامة لتفاعل نزع الماء كما يلي